João Marcos Sousa Andrade¹ e Milton Luiz Paz Lima².
¹Acadêmico do curso de Tecnologia em Gestão Ambiental
²Professor da disciplina de microbiologia geral
1. INTRODUÇÃO
Uma forma de se classificar a maioria dos fungos seria baseando-se nas características morfológicas das hifas, corpos de frutificação e esporos. O gênero Aspergillus apresenta anamorfos (fases assexuada ou mitótica) de ascomicetos da ordem Eurotiales, gênero Aspergillus, subgênero Circumdati, seção Flavi. Os gêneros são caracterizados pela produção de fiálides e conídio em cadeia seca. O conidióforo de Aspergillus é simples, sem ramificação e termina numa vesícula, onde ficam inseridas as fiálides, Chalfoun e Batista (2003), e sua forma teleomórfica sendo considerado Eumycota, subdivisão Ascomycotina na ordem Eurotiales, produzindo atravez da reprodução sexual os ascóporos, alem de um terço das espécies de Aspergillus tem os gêneros Eurotium e Emericella como seus teleomofos.
Em seu trabalho Farias (2000) descreve que, o gênero Aspergillus sp. catalogado em 1729 pelo padre italiano e biólogo Pietro Antônio Micheli. Observando o fungo no microscópio, Micheli lembrou-se da forma de um aspergillum (borrifador de água santa), e nomeou a espécie de acordo com o objeto.
Os gêneros de Aspergillus são considerados iniciadores da deterioração das sementes, contando ou não com a colaboração de alguns fatores, como pequenas aberturas nas superfícies das sementes causadas por algumas espécies de insetos e choques mecânicos resultados das praticas agrícolas durante a colheita, transporte e armazenamento, esses fatores somados as condições de umidade e temperatura promovem uma porta de entrada e um ambiente favorável para o desenvolvimento e o crescimento do propágulo.
Em específico, o Aspergillus flavus pode ser considerado fungo de armazenamento, podendo invadir sementes, Ribeiro (2003). Como esse fungo em metabolismo secundário produz micotoxinas, sendo alguns desses compostos potentes argentes cancerígenos a humanos e a animais, Hoeltz (2009). Por ser um patógeno, deve-se apresentar uma maior atenção as praticas durante o armazenamento de sementes não só de milho mas também amendoim, arroz, nozes, soja e outros grãos.
O devido cuidados com as praticas agrícolas na hora da colheita e armazenamento dos grãos, evita possíveis perdas na produção e má qualidade do produto final, grãos aparentemente sadios podem apresentar contaminação, pois o fungo apresenta como grande característica a reprodução assexuada. Como consequência uma alta velocidade de propagação quando as condições são favoráveis, gerando assim uma alta disseminação do fungo aos grãos vizinhos.
Salgado (2005) descreve no livro Manual de Fitopatologia vol. 2 sobre as doenças que o algodoeiro esta sujeito, detectaram-se manchas provocadas por fungos, principalmente Aspergillus flavus, Aspergillus niger, Rhizopurus stolonifer e Nigrospora oryzae. Esse problema cresce em importância quando a colheita do algodão é realizada em período chuvoso e o produto não é devidamente seco e armazenamento adequadamente. Em boas condições de colheita (tempo seco com dias ensolarado) esse problema não deve ocorrer.
As amêndoas da castanheira-do-brasil podem ser afetadas por diversos patógenos causadores de podridão, principalmente quando não são secas corretamente ou transportadas ou armazenadas sobre condições de umidade inadequadas. As amêndoas infectadas apresentam alteração no aspecto, odor e sabor. Dentre os vários microrganismos, o mais prejudicial e o Aspergillus flavus, por produzir substancias toxicas, denominadas aflatoxinas. O controle deve ser feito através da colheita imediata após a queda dos frutos, beneficiamento e imediato armazenamento sob condições de baixa humidade e temperatura adequada, para evitar o desenvolvimento dos fungos aprodecedores (FARIAS, 2005)
Segundo os autores Farr e Rosman (2010), no banco de dados USDA (United States Department of Agriculture), há relatos do A. flavus no mundo nas seguintes culturas Allium cepa (cebola-de-cabeça), Allium sativum (alho), Anacardium occidentale (caju), Arachis hypogaea (amendoim), Areca catechu (palmeira de betel), Astronium urundeuva (aroeira), Avena sativa (aveia), Avicennia germinans, Bauhinia purpurea, Bellis perennis (margarida-menor), Bertholletia sp, Bertholletia excelsa (castanha-do-pará), Brassica rapa, Brassica napu (canola), Butyrospermum parkii (karitê), Cajanus cajan, Cajanus indicus, Canavalia ensiformis (feijão-de-porco), Canavalia gladiata, Cannabis sativa (maconha), Carya illinoensis (nogueira-pecã), Celosia cristata (crista-de-galo), Chloris gayana (capim-de-Rhode), Cicer arietinum (grão-de-bico), Citrus aurantifolia (limão-tahiti), Citrus grandis (toranjas), Citrus latifólia (lima), Citrus limon (limão), Citrus máxima (pomelo), Citrus meyerii, Citrus reticulata (tangerina), Citrus sinensis (laranja), Citrus sp, Citrus xparadisi (toranja), Citrus xtangelo (tangelo), Cocos nucifera (coco), Cosmos bipinnatus (cosmos), Cotinus americanos, Cucumis sativus (pepino), Cucurbita moschata (abóbora-cheirosa), Cyamopsis psoralioide, Cyamopsis tetragonolobus (goma-guar), Dactylis glomerata, Daucus carota (cenoura), Dioscorea cayenensis (inhame), Diospyros lotus, Dipteryx alata (baru), Docynia indica, Eichhornia crassipes, (aguapé), Elaeis guineenses (dendezeiro), Eucalyptus tereticornis, Glycine max (soja), Gossypium hirsutum (algodão), Gossypium sp, Guizotia abyssinica (niger), Halophila ovalis, Helianthus annuus (girassol), Hordeum vulgare (cevada), Hyoscyamus albus, Ipomoea batatas (batata-doce), Lens culinaris, Lens esculenta (lentilha), Litchi chinensis, Lupinus termis, Lycopersicon esculentum (tomate), Mangifera indica (manga), Momordica charantia (melão-de-são-caetano), Morinda bracteata, Musa acuminata (banana), Musa sp., Musa textilis, Musa xparadisiaca, Narcissus sp. (narciso), Nicotiana tabacum (tabaco), Nigella sativa, Onobrychis viciifolia, Oryza sativa (arroz), Oxandra acuminata, Palicourea densiflora, Panstrongylus megistus, Passiflora edulis (maracujá), Pennisetum americanum, Pennisetum typhioideum, Phaseolus mungo, Phaseolus radiatus, Phaseolus vulgaris (feijão), Phoenix dactylifera (tamadeira), Phyllostachys bambusoides (bambu), Piper nigrum (pimenta-do-reino), Pistacia sp., Pistacia vera, Pisum sativum (ervilha), Polyrhachis sp, Prunus dulcis (amêndoa), Prunus pérsica (pêssego), Pseudomalmea diclina, Psophocarpus tetragonolobus, Punica granatum (romã), Pyrus communis (pêra), Rhodnius neglectus, Ricinus communis (mamona), Saccharum officinarum (cana-de-açúcar), Sesamum indicum (gergelim), Solanum tuberosum (batata), Sorghum bicolor, Sorghum vulgare, Thalassia testudinum, Theobroma cacao (cacau), Triatoma infestans, Triatoma sórdida, Trifolium pratense, Trifolium pratense, Trifolium repens, Triticum aestivum (trigo), Unonopsis matthewsii, Vicia faba (fava), Vigna mungo, Vigna radiata, Vigna unguiculata, Zea mays (milho), Ziziphus sp. (jujuba).
Apesar do fungo produzir frequentemente esporos que resultaram de simples divisões mitóticas, sendo mais sucessível a extinção por gerar clone, o Aspergillus flavus também apresenta em condições especiais, meiose zigótica para formar propágulos resistentes (esporos), ou seja, reprodução sexuada, os esporos provenientes dessa reprodução possuem adaptações que promoverão uma maior resistência e variabilidade genética. A fase sexuada e caracterizada pela produção de cleistotécidos, que são minúsculos corpos de frutificação, fechados e de formato arredondado. (GEISER, 1996)
As espécies de Aspergillus flavus são bastante difundidas, com presença não somente no Brasil, mas em vários países pelo mundo, a característica toxicológica de produzir substancia denominadas B1, B2, G1 e G2. Com relação aos efeitos tóxicos das aflatoxinas, foi verificado que as quatro principais aflatoxinas apresentam o seguinte grau de toxicidade: B1 >G1 >B2 >G2. Destas, a mais tóxica e cancerígena é a B1, (GLUCOS INTERNACIONAL, 2010).
Algumas de suas características a presença de hifa septada, conidióforo ampuliforme, célula condiogênica fiálide, seu conídio em formato esférico, mononematoso (ameroseptado). Coloração do verde-amarelada a verde-escuro bem característico.
O objetivo deste trabalho é apresentar aspectos gerais e morfológicos do fungo Aspergillus flavus.
2. MATERIAIS E MÉTODOS
O trabalho realizado no laboratório de Biologia Vegetal do Instituto Federal Goiano campus Urutaí.
Os propágulos do fungo foram retirados de sementes de milho (Zea mays) encubadas em gerbox com papel mata-borrão umedecido com água destilada para o desenvolvimento das colônias fúngicas, apanhou-se a semente e levou-a para visualização em microscópio estereoscópio com finalidade de se encontrar propágulos fúngicos.
Após visualização dos propágulos, utilizou-se a coleta desses pelo método de pescagem direta, utilizando uma pinça esterilizada com auxilio de estilete retira-se apenas o micélio e partes superficiais com objetivo de pescar as estruturas reprodutivas. Colocou-se o material coletado em uma lâmina contendo uma gota de fixador a base de azul de metileno (acido acético, álcool, agua e glicerina), em seguida foi acrescentada lamínula à lâmina. Retirou-se o excesso de corante com papel toalha.
Logo após a preparação da lamina levou-se ao microscópio ótico a fim de verificar se os propágulos estão realmente presentes na lamina, caso haja presença das estruturas desejadas, veda-se as laminas com esmalte incolor, aumentando assim a durabilidade do material tornando-o semi-permanente.
No microscópio óptico foi usada a menor objetiva (4x), a fim de localizar colônias e ajustar a focalização, aumentando as objetivas para 10x e posteriormente 40x observa-se as estruturas fúngicas com mais detalhes favorecendo o reconhecimento do fungo, observando aspectos morfológicos das estruturas reprodutivas. Com as características morfológicas das hifas, corpos de frutificação e esporos, compara-se com as características de alguns fungos com as literaturas disponíveis no laboratório para identificar o gênero ao qual o fungo pertence.
Após a identificação pela comparação das estruturas sexuais com as imagens da literatura, preparou-se para a realização de microfotografias das estruturas fúngicas no microscópio ótico e das frutificações fúngicas na semente no microscópio estereoscópico do fungo Aspergillus flavus, para confecção das pranchas de fotos a serem anexadas junto ao trabalho.
Foram utilizadas duas câmeras fotográficas, Sony Cyber-shot DSC-W110 e Canon Power-Shot A580.
DESCRIÇÃO MICOLÓGICA:
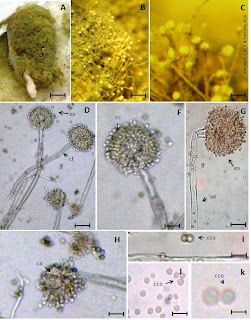
Figura 1. Aspectos morfológicos de Aspergillus flavus. A. Frutificação do fungo na semente de Zea mays (barr= 0,22cm). Em B. (barr= 47,68µm) e C. (barr= 23,84µm), presença de frutificação com micélio produzindo esporos. D. Esporos (es) e conidióforo (cf) (barr= 6,81µm). Célula conidiogênica (cc) F. (barr= 3,4µm). Em G. Esporos (es) e septo (se) (bar= 4,54µm). Célula ampuliforme (ca) H. (barr= 4,54µm). Em detalhe os conídios (cco) em I., J. (barr= 0,95µm) e K. (barr= o,42µm).
Descrição Micológica:
O Aspergillus flavus apresenta em sua colônia coloração verde-amarelada, um dos fatores que caracteriza a sua presença (Figura 1 A, B e C), seu micélio externo responsável pela característica de patógeno superficial. Os conidióforos são septados (Figura 1 G), essas frutificações produzem esporos (Figura 1D) que se desenvolvem e multiplicam de forma assexual através dos conídios (Figura 1 I e J), esses produzidos pelas cêluas ampuliformes (Figura 1 H) através da célula conidiogênica (Figura 1 F). Os conidióforos são simples de formato esférico e ameroseptado, produzidos em cadeia ao redor de uma célula conidiogênica.
LITERATURA CITADA.
CHALFOUN S.M. & BATISTA L.R., Fungos associados a frutos e grãos do café, Aspergillus & Penicillium 2003.
Estudos em Doenças de Plantas – Dr. Milton Luiz da Paz Lima, Aspectos Gerais e Morfológicos do Fungo Aspergillus flavus. Disponível em <http://fitopatologia1.blogspot. com/2010/07/aspectos-gerais-e-morfologicos-do-fungo_4512.html>, acessado em outubro de 2010.
FARIAS A. X., Contaminção Endógenica por Aspergillus spp. Em Milho Pós-Colheita no Estado do Paraná, Pesq. agropec. bras., Brasília, v.35, n.3, p.617-621, mar. 2000.
Farr, D.F., & Rossman, A.Y. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. Ddisponível em:
GEISER, D.M., Loss of Meiosis in Aspergillus, Mol Biol Evol-1996.
GEISER, D.M., Cryptic speciation and recombination in the aflatoxin-producing fungus Aspergillus flavus, Proc. Natl. Acad. Sci. USA Vol. 95, pp. 388–393, January 1998.
GEISER, D.M., The Phylogenetics of Mycotoxin and Sclerotium Production in Aspergillus flavus and Aspergillus oryzae, Fungal Genetics and Biology 31, 169–179 (2000).
GEISER, D.M., The current status of species recognition and identiication in Aspergillus, Studies in Mycology 59: 1–10. 2007.
Glucos Internacional, Aflatoxinas. Disponível em: <http://www.glucosinternacional.com/ sumario/sumario.php>, acessado outubro de 2010.
HOELTZ M., Micobiota e micotoxinas em amostras de arroz coletadas durante o sistema estacionário de secagem e armazenamento, Revista Ciência Rural v.39, n.3, Santa Maria, p.803-808, mai-jun, 2009.
Krugner T. L. e Bacchi, L. M. A., Manual de Fitopatologia, volume 2, Doenças das Plantas Cultivadas, cap 4.
RIBEIRO, S. A. L., Fungos filamentosos isolados de produtos derivados do milho comercializados em Recife, Pernambuco, Revista Brasil. Bot., V.26, n.2, p.223-229, jun. 2003.




Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.