Esta página está sob responsabilidade do professor Dr. Milton Luiz Paz Lima, maiores considerações aponte comentários nas publicações sinta-se a vontade para escrever para milton.lima@ifgoiano.edu.br
Páginas
▼
quinta-feira, 29 de dezembro de 2011
Uso de plantas como fitoterápico - absurdos!
Dr. Drauzio Varella mostra químico que fabrica produtos à base de plantas:
Em Goiás, laboratório realiza análise de ferrugem asiática gratuitamente
Imagem retirada do Site
terça-feira, 27 de dezembro de 2011
Avaliacao de Resistencia de germoplasma de soja a Phakopsora pachyrhizi
Aos 27 dias apos o plantio até agora nas cultivares precoces e tardias, nao foi verificado sinais de Phakopsora pachyrhizi.
O germoplasma no campo em estadio fenologico V4, apresentou incidencia de mildio causado por Peronospora manshurica, na amplitude de 0-4% de area de tecido foliar lesionado. Aqui na regiao de Uruaí, está havendo uma forte predominancia de chuvas diarias, que provavelmente esta favorecendo a incidencia da doença.
Nao foi observado nas amostras focos de ferrugem asiatica. O campo está sendo avaliado com intervalos de sete em sete dias.
O germoplasma no campo em estadio fenologico V4, apresentou incidencia de mildio causado por Peronospora manshurica, na amplitude de 0-4% de area de tecido foliar lesionado. Aqui na regiao de Uruaí, está havendo uma forte predominancia de chuvas diarias, que provavelmente esta favorecendo a incidencia da doença.
Nao foi observado nas amostras focos de ferrugem asiatica. O campo está sendo avaliado com intervalos de sete em sete dias.
 |
| Sintoma de mildio - Peronospora manshurica em germoplasma de soja cultivado na cidade de Urutaí (GO) - sudoeste. |
 |
| Visualizacao dos sinais do patogemo (esporangios e esporangioforos) na face abaxial. |
 |
| Visao geral do experimento, |
 |
| Detalhe da falha da germinacao de sementes de alguns acessos. |
 |
| Sintoma de mildio - Peronospora manshurica. |
Clorose e sintoma de mildio - Peronospora manshurica.
domingo, 25 de dezembro de 2011
sábado, 24 de dezembro de 2011
Práticas em Microbiologia: Isolamento e Repicagem de Fungos - Aluna Ana Carolina Damião Araújo - Prof. Milton Luiz da Paz Lima.
Titulo: Isolamento e repicagem de fungos.
Aluna: Ana Carolina Damião Araújo
Introdução:
O vídeo tem como objetivo, apresentar de forma prática e facilitada, o modo de realizar isolamento e repicagem de fungos patogênicos e não patogênicos.
O isolamento de fungos é obtido em cultura pura apartir de tecidos doentes do hospedeiro, quando obtido um organismo em cultura pura não significa que ele seja o agente causal da doença. Vários meios são utilizados porém o mais usado é o Batata-Dextrose-Ágar (BDA) e Extrato de Malte-Ágar (EMA). O organismo é cultivado em placas de Petri, repicado em tubos com meio BDA inclinado, para ser armazenado.
Os métodos básico de isolamento são: direto e indireto. O isolamento direto é a transferência com auxilio de um estilete, de estruturas do patógenos (hifas, esporos, rizomorfos, escleródios) direto do órgão infectado, quando a pretensão é trabalhar com esporos e a amostra não apresenta pode-se estimular a esporulação mantendo a amostra em uma câmara úmida (de um a três dias) .
O isolamemento indireto é a transferência para meio de cultura, de porções infectadasde tecido do hospedeiro.O isolamento indireto varia de acordo com o órgão ou tecido infectado. O patógeno está dentro dos tecidos da planta sem produzir frutificações na superficie do orgão lesionado. Para evitar a incidência de contaminantes ,o material recém-infectado, que o patógeno se encontraem crescimento ativo. O isolamento de fungos dos tecidos de órgão não-lenhosos, organismos saprófitas na superficie do órgão lesionado são elminado pela desifestaçãosuperficialde tecidos em solução desinfetante, o patógeno encontra-se no interior dos tecidos não é afetado pelo desinfetante a menos que o tempo seja longo.
As repicagens são métodos de rotina mais usados para manutenção de culturas, que consiste na repicagem periódica do microorganismo em novos tubos de ensaio que contêm meio de cultura, os tubos são submetidos a temperatura que favoreça o crescimento do patógeno até que haja a colonização do meio de cultura. Para evitar contaminações deve-se usar tampões de algodão hidrófobo. As repicagens pode induzir o patógeno ao hábito saprofítico, à alteração de sua morfologia, à diminuição e à perda de sua capacidade de sua esporular e à diminuição de sua agressividade. Na repicagem devem-se transferir apenas porções jovens e esporulantes da colônia.
Materiais necessários:
Para realizar o isolamento são necessarios os seguintes materiais: microscópio estereoscópio (lupa), estilete, lamparina com álcool,placas de petri com meio BDA e tubos de ensaio com BDA inclinado.
Para a repicagem são necessários: culturas de microorganismo em placa de petri, frascos esterilizados de 10 mL de capacidade e água destilada ou solução NaCl 0,85% esterilizadas.
Metodologia:
O isolamento direto são usados os procedimentos de focalizar as estruturas do patógeno em lupa, flambar o estilete, resfriar a ponta do estilete tocando levemente no meio de cultura, transferir estruturas visualizadas para um placa com meio de cultura, incubar até o aparecimento da colônia desejada e repicar a colônia em tubos com BDA inclinado.
O isolamento indiretosão usados os procedimentos de lavar o material infectado cuidadosamente com água e detergente, enxugar com papel, com o auxilio de uma lâmina flambada retirar fragmentosdas margens da lesãoe transferir para a solução aquosa de álcool 70%, transferir fragmentos de tecidos para a solução desinfestante mantendo-os imersos na solução,1 min. é o bastante para eliminar os contaminantes,com a pinça flambada remover fragmentos da solução desinfestante, plantar três ou quatropor placa contendo meio de cultura, manter as placas em encubadoras e repicar a colônia em tubos com BDA inclinado.
A repicagem é efetuada através dos procedimentos: colocar 5mLde água destilada esterilizada ou solução de NaCl 0,85% em frascosde vidro de 10 mL de capacidade, com condições assépticas colocar em cada frasco cinco discos de cultura do fungo, vedar os frascos com algodãoe armazenar em sala refrigerada.
Conclusões:
Conclui-se que o isolamento tem como vantagem permitir obter organismo puro, isento de contaminações de microorganismossaprófitas associados ao tecido infectado, permitir saber qual organismo está sendo transferido para o meio e permitirestabelecer comparações entre as estruturas do organismo formadas na superfície do hospedeiro e em cultura.
O método da repicagem para trabalhos com fungos fitopatogênicos realizados num prazo de um semestre, o método pode ser utilizado com sucesso. Este método é usado para manutenção de culturas à curto prazo.
Referências Bibliográficas:
CASTELLANI, A. Viability of some pathogenic fungi in distilled water. J. Trop. Med. Hyg. 42:225, 1939.
DHINGRA, O.D. & SINCLAIR, J.B. Basic plant pathology methods. Boca Raton: CRC Press, 1995. 434 p.
ESFS Disponivel em:www.esfs.br/disciplinas/bio221/isolamento_de_fungos.rtf, acessado em dezembro de 2011.
FIGUEIREDO, M.B. Métodos de preservação de fungos fito patogênicos. Biológico 63:59-68,2001.
GONÇALVES, R.C.; ALFENA, A.C.; MAFIA, L.A. & CROUS, P.W. Evaluation of biossays to quatify Cylindrocladium inocula in soil. Mycoscience 41:216-4, 2001.
JOHANSON, A. Detections of sigatoka leaf spot pathogens of banana: by the polymerase chain reaction. [S.I.] : Natural Resources Institut, 1997. 37 p.
RIKER, A.J & RIKER, R.S. Introduction to research on plant diseases. St. Louis: John S. Swift Co.,1936.
Aspectos gerais e morfológicos de Colletotrichum truncatum
Aspectos gerais e morfológicos de Colletotrichum truncatum
José Carlos Marra Filho
Acadêmico do curso de agronomia
INTRODUÇÃO
Colletotrichum truncatum (Schwein) foi descrito pela primeira vez por Andrus e W. D. Moore (1935). Seu anamorfo possui a seguinte posição taxonômica: família Glomerellaceae, subclasse Sordariomycetidae, classe Sordariomycetes, divisão Ascomycota e reino Fungi (INDEX FUNGORUM, 2011).
O C. truncatum é um fungo mitospórico, cujo teleomorfo pertence ao gênero Glomerella classificado como pertencente ao filo Ascomycota, ordem Phyllachorales, família Phyllacoraceae (HAWKSWORTH et al., 1995).
Segundo Cannon (2005), C. truncatum possui alguns sinônimos como, Vermicularia truncata, Colletotrichum dematium sp (INDEX FUNGORUM, 2011).
Existem 265 registros de ocorrência de C. truncatum infectando diversas hospedeiras no mundo. Deste total de registros ocorridos no mundo, 118 hospedeiras de C. truncatum foram encontradas registradas no banco de dados Farr e Rosmman (2011).
As famílias botânicas que são infectadas com maior frequência por C. truncatum são: Fabaceae, Poaceae, Solanaceae, Malvaceae (FARR E ROSMMAN, 2011).
No Brasil, 20 hospedeiras encontram-se registradas, segundo Farr e Rosmman (2011), representadas por Aeschynomene paniculata (LENNE, 1990), Galactia striata (LENNE, 1990), Glycine max (MENDES et al., 1998), Lupinus albus (MENDES et al., 1998), Lupinus luteus (MENDES et al., 1998), Phaseolus lunatus (Anthracnose.) (MENDES et al., 1998), Phaseolus lunatus var. macrocarpus (MENDES et al., 1998), Phaseolus vulgaris (Anthracnose; stem anthracnose) (MENDES et al., 1998) , (DAMM, 2009), Stylosanthes capitata (LENNE, 1990), Stylosanthes guianensis (LENNE, 1990), Stylosanthes hamata (LENNE, 1990), Stylosanthes humilis (LENNE, 1990), Stylosanthes pilosa (LENNE, 1990), Stylosanthes scabra (LENNE, 1990), Stylosanthes sp. (MENDES et al., 1998), Vigna unguiculata (MENDES et al., 1998), Zornia glabrata (LENNE, 1990), Zornia glochidiata (LENNE, 1990), Zornia latifolia (LENNE, 1990) e Zornia sp. (LENNE, 1990).
A antracnose é uma das principais doenças do cerrado. Em ambiente de alta umidade ela causa a abertura das vargens, o apodrecimento das vargens e sementes da soja, à morte prematura das vargens e germinação dos grãos em formação (YORINORI et al., 1993).
O fungo pode atacar também regiões como, São Paulo, Minas Gerais e sul do Brasil. Apesar de causar bastantes danos em locais com umidade alta, plantios densos ou em caso da planta madura ficar no campo por questão de chuvas, a antracnose de modo geral não se mostra como prejuízo sério de maneira geral para as lavouras. Em tais condições observam-se plantas amareladas o que é referido como “mosqueado” (ELKE, 1980).
A doença pode prejudicar também a haste e outras partes das plantas causando manchas castanho-escuras, além de possivelmente ser causadora da podridão do pecíolo que, nos últimos anos, tem trazido muitos danos e perdas nas lavouras do cerrado (YORINORI et al., 1993).
Segundo Yorinori, et al. (1993), na região sul, em épocas com um prolongamento maior da chuva, após o plantio direto da soja sobre a palhada do trigo, há bastante morte entre os trinta dias de plântulas, dependendo das vezes tendo que fazer o replantio do mesmo. Alta incidência de morte de plântulas por antracnose tem sido observada nas variedades Primavera e Invicta. Algumas observações feitas no campo mostram que, a doença não atinge a cultura por inteiro mais sim alguns grupos de plantas, o que alguns pesquisadores pensam que certas plantas têm resistência genética.
Inóculo proveniente de restos de cultura e sementes infectadas pode causar necrose dos cotilédones, que pode acabar se estendendo para o hipocólito, causando o tombamento de pré e pós-emergência. O fungo ataca as partes laterais da planta, pecíolos e vargens em qualquer estagio de formação. A doença pode causar a queda total das vargens ou deterioração das sementes em colheita retardada. Nos estágios R3-R4 as plantas começam a adquirir as manchas e ficam retorcidas. Em altas umidades o fungo já começa a ser visível por pontuações negras na planta, ou seja, são as frutificações do fungo (ALMEIDA et al., 2005).
No período de março de 2004 a janeiro de 2005 foi avaliada a resistência de 48 cultivares comerciais de soja a Colletotrichum truncatum. Plântulas de soja foram inoculadas no estádio V1/V2 e, após as inoculações, foram mantidas em casa de vegetação, sob condições de umidade relativa do ar acima de 95%, durante 10 dias. Após esse período, as plântulas foram avaliadas para determinar a reação das cultivares. A severidade dos sintomas foi obtida pela avaliação das lesões nas folhas, determinando-se os graus de resistência das plântulas através de uma escala de notas de severidade, com valores de 1 a 9. Somente as cultivares Tabarana, Cometa e EMGOPA 316 foram suscetíveis a Colletotrichum truncatum (SCIELO, 2011).
C. truncatum é um patógeno de plantas que vem mostrando resultados como um bio-herbicida contra a planta daninha Sesbania exaltata. Estudos anteriores mostraram uma quantidade similar de esporos produzidos por mililitros de meio de cultura em fermentação líquida e em estado sólido. Neste estudo, os esporos do fungo foram produzidos em líquido (LC), sólido por vermiculita (SV) e sólido por perlite, fubá e ágar (SP). Após a secagem à temperatura ambiente com fluxo de ar, SV e SP manteve com mais viabilidade. Cada produto foi então armazenado há 4º, 15º e 25º C. Dos três produtos armazenados, SP manteve maior viabilidade. Eficácia com base em ensaios utilizando o mesmo número de esporos viáveis, os esporos do meio SV e SP, mostraram sintomas da doença mais grave do que no meio LC (SCIENCI DIRECT, 2011).
O fungo C. truncatum não é utilizado em alimentos e não tem importância industrial, pois ele é um patógeno vegetal, não fazendo mal algum a animais e seres humanos (PAUL, 2005).
A espécie em estudo é um parasita obrigatório podendo ocorrer em variadas espécies de plantas (SBFITO, 2011).
O gênero desse fungo possui aproximadamente 706 espécies válidas em literatura, onde a maioria são fitopatogênicos (INDEX FUNGORUM, 2011).
O objetivo deste trabalho é apresentar os aspectos gerais e morfológicos do fungo Colletotrichum truncatum.
O trabalho foi feito no Laboratório de Microbiologia do Instituto Federal Goiano campus Urutaí.
O processo para encontrar os propágulos do e verificar suas estruturas é a visualização em microscópio estereoscópico.
Após a visualização dos propágulos devemos coletá-los da superfície foliar com o auxílio de uma pinça e colocá-los em uma lâmina contendo uma gota de fixador lactofenol cotton-blue, em seguida colocar-se uma lamínula sobre a lâmina. Retirar-se o excesso de corante com papel higiênico, logo após vedar-se com esmalte e levar o conjunto para visualização em microscópio ótico. No microscópio a primeira objetiva a ser usada deve ser a menor (4x), para que possamos observar se os propágulos foram depositados na lâmina, após a observação destes, aumentamos as objetivas para os aumentos de 10x e 40x, para se observar as estruturas fúngica com mais detalhes.
Para esse trabalho foram realizadas microfotografias das estruturas fúngica no microscópio ótico e das frutificações fúngica no microscópio estereoscópico, utilizando câmera digital Canon® modelo Power Shot A580 do professor Milton Luiz da Paz Lima.
 Figura 1. Aspectos morfológicos de Colletotrichum truncatum. A., B. e C. setas (s) (bar = 62c µm) e acérvulos (ac), D. e E. Conídios hialinos (c) (bar = 17,5c µm x 51 µm).
Figura 1. Aspectos morfológicos de Colletotrichum truncatum. A., B. e C. setas (s) (bar = 62c µm) e acérvulos (ac), D. e E. Conídios hialinos (c) (bar = 17,5c µm x 51 µm).Descrição Micológica:
O fungo Colletotrichum truncatum possui ciclo sexual ou forma teleomórfica desconhecida ou ausente (NEYLSON, 1993).
Na amostra analisada foi encontrado o fungo na sua forma anamórfica, onde os acérvulos eram circulares (Fig. 1B e C). Os conídios podem ser em formato hialino, oval, oblongo ou falcado. Na figura o fungo tem formato hialino (Fig. 1D e E). A massa de conídios com coloração rósea. Podem estar presentes no acérvulo com setas longas, septadas e pigmentadas podendo se formar juntamente ao tecido de seu hospedeiro, setas escuras com tonalidades pretas (Fig. 1A) com célula basal arredondada (CARDOSO, 1978).
Os conídios são levemente curvos, mais largos no centro e gradativamente mais finos em direção às extremidades, onde a largura corresponde a aproximadamente metade da região central. Quando maduros, possuem coloração marrom e freqüentemente germinam através das células apicais e basais. Os tubos germinativos originários destas células formam apressório. O número de núcleos presentes em cada célula do conídio pode variar de 1-14, sendo mais comumente encontradas células binucleadas (UESB, 2011).
Alguns fatores do ambiente podem influenciar o desenvolvimento do fungo. A temperatura ótima para esporulação está em torno de 28°C, embora possa ocorrer esporulação desde 10 até 35°C. A liberação de esporos não é muito influenciada pela temperatura e normalmente ocorre na faixa de 15 a 35°C. Em relação à germinação, temperaturas compreendidas entre 25 e 28°C favorecem o processo. Quanto à umidade, a produção de conídios sobre as lesões tem início quando a umidade relativa atinge no mínimo 93%. Para a germinação, há necessidade de água livre, pois raramente o esporo germina sob condições de ar saturado. O desenvolvimento do micélio é favorecido por umidade relativa próxima de 93% também. A luz também pode ter influência sobre o micélio e os esporos. Embora o crescimento do micélio, a germinação de conídios e a elongação do tubo germinativo sejam processos inibidos pela luz, a alternância da mesma tem um papel importante sobre a produção de esporos. Estes começam a ser liberados tão logo escureça, alcançam um máximo em poucas horas e praticamente cessam na alvorada; sob condições de luz ou escuro contínuo, a esporulação cai a níveis muito baixos, voltando a aumentar quando os períodos de luz e escuro novamente voltarem a se alternar (UESB, 2011).
Tabela 1. Comparação dos elementos morfométricos de C. truncatum.
| Descrição Morfológica | Marra (2011) | Eken e Demirci (2000) | Paz Lima (2011) |
| Conídios | 15-19,5 x 3-5,1 | 16,3-20,6 x 3,1-4,5 | 8-16 x 2-5,5 |
| Setas | 60,5-72 x 6,3-8 | - | 62-70,3 x 6-8,3 |
Eken e Demirci (2000) desenvolveram um estudo sobre o fungo C. truncatum na Turquia onde eles observaram o primeiro caso do mesmo em alfafa. Ao desenvolverem o estudo eles fizeram a descrição micológica e a medida das estruturas (Fig. 2) como os conídios, que se apresentavam hialinos, unicelulares, falcados e quase reto, com uma área de destaque clara no centro do citoplasma altamente granular (APS, 2011).
Com base na tabela pode-se dizer que as medidas ficaram proporcionais, ou seja, não houve uma variação muito grande entre as medidas de cada autor.
APS – AMERICAN PHYTOPATHOLOGICAL SOCIETY, banco de dados para consulta de publicações. Disponível em:, acessado em dezembro de 2011.
DAMM, U., WOUDENBERG, J.H.C., CANNON, P.F., AND CROUS, P.W. Colletotrichum species with curved conidia from herbaceous hosts. Fung. Diversity 39: 45-87. 2009.
FARR, D.F., & ROSSMAN, A.Y. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. Disponível em: , acessado em 12 de dezembro de 2011.
FRANCISCO V. J., Soja planta, clima, pragas, moléstias e invasoras Vol. 1. Editora R. Vieira. Campinas – SP, 1983.
HAWKSWORTH, D.L.; KIRK, P.M.; SUTTON, B.C.; PEGLER, D.N. AINSWORTH & BISBY’S. Dictionary of the fungi. Cambridge: CAB International, 8º ed., 616 p. 1995.
INDEX FUNGORUM, banco de dados para consulta de táxons fúngicos. Disponível em:, acessado em dezembro de 2011.
KIMATI, H. et al., Manual de Fitopatologia Vol. 2, Doenças das Plantas Cultivadas, 4ª edição. Editora Agronômica Ceres. São Paulo, 2005.
LENNE, J. M.. World List of Fungal Diseases of Tropical Pasture Species. Phytopathol. Pap. 31: 1-162. 1990.
MENDES, M.A.S., DA SILVA, V.L., DIANESE, J.C., AND ET AL. Fungos em Plantas no Brasil. Embrapa-SPI/Embrapa-Cenargen, Brasilia, 555 pages. 1998.
NEYLSON E. A., PLÍNIO I. M. S., Cultura de soja nos serrados. Editora Ave – Maria. Piracicaba – SP, 1993.
PAUL, S. Mycelium running, How Mushrooms Can Help Save the World. Editora Berkeley Toronto – USA, 2005.
SCIENCI DIRECT, banco de dados para consulta de artigos. Disponível em:, acessado em dezembro de 2011.
SCIELO – SCIENTIFIC ELECTRONIC LIBRARY ONLINE, banco de dados para consulta de artigos. Disponível em:, acessado em dezembro de 2011.
SBFITO – SOCIEDADE BRASILEIRA DE FITOPATOLOGIA, banco de dados para consulta de publicações. Disponível em:, acessado em dezembro de 2011.
UESB – UNVERSIDADE ESTADUAL DO SUDESTE DA BAHIA, Fitopatologia, banco de dados para consulta. Disponível em:, acessado 31 de outubro de 2011.
sexta-feira, 23 de dezembro de 2011
Descriçao Micológica - Fusarium Decemcellulare
Aspectos gerais e morfológicos de Fusarium decemcellulare
Osvânio Lino Nunes Junior
Acadêmico do curso de Agronomia
INTRODUÇÃO
Existem atualmente, segundo Index Fungorum (2011), 1419 descrições, dentre espécies, formae speciales, variedades e subespécies de Fusarium sp., dentre essas espécies está fungo Fusarium decemllulare foi descrito pela primeira vez em 1908 por Angew Vereinigt, segundo sua taxonomia pertencente aos fungos anamórficos, ordem Moniliales e família Tuberculariaceae, possui como teleomorfo Albonectria rigidiuscula, sinonímia Calonectria rigidiuscula. (INDEXFUNGORUM, 2011)
O gênero Fusarium abriga 725 espécies e subspécies, como: Species: ZipcodeZoo has pages for 775 species and subspecies in the Genus Fusarium: F. acaciae · F. acicola · F. acremoniopsis · F. acridiorum · F. acuminatum · F. acuminatum armeniacum · F. acutatum · F. adesmiae · F. aecidii-tussilaginis · F. aeruginosum · F. affine · F. agaricorum · F. ailanthinum · F. alabamense · F. albertii · F. album · F. album var. album · F. aleurinum · F. aleyrodis · F. alkanophilum · F. allescherianum · F. allii-sativi · F. ambrosium · F. amentorum · F. amethysteum · F. andinum · F. andiyazi · F. andropogonis · F. anguioides · F. anguioides caudatum · F. anguioides var. anguioides · F. angustum · F. annulatum · F. anomalum · F. anthophilum · F. apii var. apii · F. apii var. pallidum · F. apiogenum · F. aquaeductuum · F. aquaeductuum var. aquaeductuum · F. aquaeductuum var. elongatum · F. aquaeductuum var. medium · F. aqueductum · F. arachnoideum · F. arcuatum · F. arcuatum var. arcuatum · F. arcuatum var. majus · F. arcuosporum · F. argillaceum · F. aridum · F. arthrosporioides · F. arthrosporioides var. asporotrichum · F. arundinis · F. arvense · F. asclepiadeum · F. asperifoliorum · F. atrovirens · F. audinum · F. aurantiacum · F. aureum · F. avenaceum subsp. aywerte · F. avenaceum f. fabae · F. avenaceum nurragi · F. avenaceum var. volutum · F. azedarachinum · F. babinda · F. baccharidicola · F. bacilligerum · F. bactridioides · F. bagnisianum · F. bambusicola · F. baptisiae · F. barbatum · F. bartholomaei · F. batatas var. batatas · F. batatatis · F. batatatis var. vanillae · F. begoniae · F. beomiforme · F. berenice · F. betae · F. biasolettianum · F. biforme · F. bipunctatum · F. biseptatum · F. blasticola · F. bonordenii · F. bostrycoides · F. botrycoides · F. brachygibbosum · F. brassicae · F. brevicatenulatum · F. briosianum · F. bucharicum · F. bufonicola · F. bugnicourtii · F. buharicum · F. bulbicola · F. bulbigenum · F. bulbigenum var. blasticola · F. bulbigenum var. coffeae · F. bulbigenum var. nelumbicolum · F. bullatum · F. bullatum roseum · F. bullatum var. roseum · F. butleri · F. buxicola · F. calcareum · F. calidariorum · F. callosporum · F. camerunense · F. camptoceras · F. candidulum · F. candidum · F. cannabis · F. capitatum · F. caricis · F. caries · F. carneolum · F. carneoroseum · F. carneum · F. carpineum · F. carpini · F. cataleptum · F. catenulatum · F. caucasicum · F. caudatum · F. caudatum solani · F. caudatum volutum · F. cavispermum · F. celosiae · F. celtidis · F. cepae · F. cerasi · F. cerealis · F. chaetomium · F. chilense · F. chlamydosporium · F. chlamydosporum var. chlamydosporum · F. chlamydosporum var. chlamydosporum · F. chlamydosporum var. fuscum · F. chrysanthemi · F. ciliatum · F. cinctum · F. cinerea · F. cinereum (Imitator Damsel) · F. cinnabarinum · F. circinatum · F. cirrosum · F. citrinum · F. citrulli · F. clavatum · F. clypeaster · F. coccidicola · F. coccinellum · F. coccineum · F. coeruleum · F. coffeicola · F. commune · F. commutatum · F. compactum · F. concentricum · F. concolor · F. conglutinans · F. conglutinans callistephi · F. conglutinans var. citrinum · F. congoense · F. coniosporiicola · F. constrictum · F. corallinum · F. cromyophthoron · F. crookwellense · F. cubense · F. cucumerinum · F. cucurbitariae · F. culmorum · F. culmorum leteius · F. culmorum var. leteius · F. cuneiforme · F. cyclogenum · F. cydoniae · F. cymbiferum · F. cypericola · F. de-tonianum · F. decemcellulare · F. decemcelulare · F. deformans · F. delacroixii · F. denticulatum · F. desciscens · F. dianthi · F. didymum · F. diffusum · F. dimerum · F. dimerum var. dimerum · F. dimerum var. nectrioides · F. dimerum var. pusillum · F. dimerum var. violaceum · F. dimorphum · F. diplosporum · F. discoideum · F. discolor · F. discolor sulphureum · F. diversisporum · F. dlamini · F. dlaminii · F. effusum · F. elasticae · F. elegans · F. elongatum · F. ensiforme · F. epicoccum · F. episphaeria · F. episphaericum · F. epistroma · F. epithele · F. equinum · F. equiseti · F. equiseti var. bullatum · F. equiseti var. caudatum · F. equiseti var. intermedium · F. equiseticola · F. equisetorum · F. erubescens · F. eucalypticola · F. eucalyptorum · F. eumartii · F. expansum · F. falcatum · F. falcatum fuscum · F. ferruginosum · F. fijikuroi · F. filiferum · F. filisporum · F. fissum · F. flavidum · F. flavum · F. flocciferum · F. foeni · F. foetens · F. foliicola · F. fractiflexum · F. fractum · F. fragrans · F. fraxini · F. fructigenum · F. fujikuroi · F. fuliginosporum · F. funicola · F. fusariodes · F. fuscum · F. gaditjirri · F. gallinaceum · F. gemmiperda · F. genevense · F. georginae · F. gibbosum · F. gigas · F. gladioli · F. glandicola · F. globosum · F. globulosum · F. gloeosporioides · F. glumarum · F. gracile · F. graminearum · F. graminum · F. granulosum · F. guttiforme · F. gymnosporangii · F. hakeae · F. heidelbergense · F. heleocharidis · F. helotioides · F. herbarum · F. heteronemum · F. heterosporoides · F. heterosporum · F. heterosporum var. congoense · F. heveae · F. hibernans · F. hippocastani · F. hordearium · F. hordei · F. hostae · F. hymenula · F. hyperoxysporum · F. hypocreoideum · F. idahoanum · F. illosporioides · F. inaequale · F. incarcerans · F. incarnatum · F. inflexum · F. inseptatum · F. insidiosum · F. iridis · F. japonicum · F. javanicum · F. javanicum javanicum · F. javanicum var. ensiforme · F. javanicum var. radicicola · F. juglandinum · F. junci · F. juruanum · F. konzum · F. kyushuense · F. laboulbeniae · F. laceratum · F. lacertatum · F. lactis · F. lagenariae · F. lagenarium · F. lanceolatum · F. laricis · F. larvarum var. rubrum · F. larvarum var. larvarum · F. larvarum var. rubrum · F. lateritium · F. lateritium f. crotalariae · F. lateritium f. pini · F. lateritium var. buxi · F. lateritium var. minus · F. lateritium var. mori · F. lateritium var. tenue · F. lateritium var. uncinatum · F. laxum · F. leguminum · F. leucoconium · F. lichenicola · F. limonis · F. limosum · F. lineare · F. lini · F. loliaceum · F. lolii · F. longipes · F. longisporum · F. longissimum · F. longum · F. lucidum · F. lunulosporum · F. luteum · F. lutulatum · F. lutulatum var. zonatum · F. lutulatum zonatum · F. lycopersici · F. macroceras · F. maculans · F. magnusianum · F. mali · F. malli · F. mangiferae · F. marginatum · F. martii · F. martii minus · F. martii phaseoli · F. martii viride · F. matuoi · F. mauroi · F. maydiperdum · F. maydis · F. medicaginis · F. melanochlorum · F. melonis · F. merismoides · F. merismoides var. acetilereum · F. merismoides var. chlamydosporale · F. merismoides var. crassum · F. merismoides var. merismoides · F. merismoides var. violaceum · F. mesentericum · F. metachroum · F. microcera · F. microcera var. cerasi · F. microphlyctis · F. micropus · F. microspermum · F. microsporium · F. mikaniae · F. miniatulum · F. miniatum · F. minimum · F. minutissimum · F. minutulum · F. miscanthi · F. moniliforme · F. moniliforme f. moniliforme · F. moniliforme f. subglutinans · F. moniliforme var. fici · F. moniliforme var. intermedium · F. moniliforme var. minus · F. moniliforme var. moniliforme · F. moronei · F. moschatum · F. musarum · F. mycophilum · F. myosotidis · F. napiforme · F. neglectum · F. nelsonii · F. neoceras · F. nervisequum · F. nervisequum f. platani · F. nicotianae · F. nigrum · F. nisikadoi · F. nitidum · F. nivale · F. niveum · F. nygamai · F. obtusatum · F. obtusisporum · F. obtusiusculum · F. obtusum · F. ochraceum · F. oidioides · F. opuli · F. orobanches · F. orthoceras · F. orthoceras triseptatum · F. orthoceras var. lathyri · F. orthoceras var. longius · F. orthosporum · F. osiliense · F. ossicola · F. osteophilum · F. oxydendri · F. oxysporum apii · F. oxysporum aechmeae · F. oxysporum albedinis · F. oxysporum apii · F. oxysporum asclerotium · F. oxysporum asparagi · F. oxysporum basilici · F. oxysporum batatas · F. oxysporum betae · F. oxysporum bouvardiae · F. oxysporum callistephi · F. oxysporum cannabis · F. oxysporum carthami · F. oxysporum cassiae · F. oxysporum cattleyae · F. oxysporum cepae · F. oxysporum chrysanthemi · F. oxysporum ciceris · F. oxysporum citri · F. oxysporum coffeae · F. oxysporum conglutinans · F. oxysporum crotalariae · F. oxysporum cubense · F. oxysporum cucumerinum · F. oxysporum cucurbitacearum · F. oxysporum cyclaminis · F. oxysporum dianthi · F. oxysporum elaeidis · F. oxysporum f. apii · F. oxysporum f. batatas · F. oxysporum f. betae · F. oxysporum f. callistephi · F. oxysporum f. cepae · F. oxysporum f. conglutinans · F. oxysporum f. cubense · F. oxysporum f. cucumerinum · F. oxysporum f. cyclaminis · F. oxysporum f. dianthi · F. oxysporum f. fabae · F. oxysporum f. gladioli · F. oxysporum f. lini · F. oxysporum f. lupini · F. oxysporum f. lycopersici · F. oxysporum f. medicaginis · F. oxysporum f. melongenae · F. oxysporum f. melonis · F. oxysporum f. narcissi · F. oxysporum f. nicotianae · F. oxysporum f. niveum · F. oxysporum f. oxysporum · F. oxysporum f. passiflorae · F. oxysporum f. perniciosum · F. oxysporum f. phaseoli · F. oxysporum f. pini · F. oxysporum f. pisi · F. oxysporum f. psidii · F. oxysporum f. raphani · F. oxysporum f. spinaciae · F. oxysporum f. tracheiphilum · F. oxysporum f. tuberosi · F. oxysporum f. udum · F. oxysporum f. vasinfectum · F. oxysporum fabae · F. oxysporum fatshederae · F. oxysporum fragariae · F. oxysporum gladioli · F. oxysporum glycines · F. oxysporum hebes · F. oxysporum lagenariae · F. oxysporum lentis · F. oxysporum lilii · F. oxysporum lini · F. oxysporum lupini · F. oxysporum lycopersici · F. oxysporum matthiolae · F. oxysporum medicaginis · F. oxysporum melongenae · F. oxysporum melonis · F. oxysporum narcissi · F. oxysporum nicotianae · F. oxysporum niveum · F. oxysporum opuntiarum · F. oxysporum oxysporum · F. oxysporum passiflorae · F. oxysporum perniciosum · F. oxysporum phaseoli · F. oxysporum pini · F. oxysporum pisi · F. oxysporum psidii · F. oxysporum radicis-lycopersici · F. oxysporum ranunculi · F. oxysporum raphani · F. oxysporum rauvolfiae · F. oxysporum resupinatum · F. oxysporum rhois · F. oxysporum sesami · F. oxysporum spinaciae · F. oxysporum tracheiphilum · F. oxysporum tuberosi · F. oxysporum tulipae · F. oxysporum vanillae · F. oxysporum var. lycopersici · F. oxysporum var. medicaginis · F. oxysporum var. meniscoideum · F. oxysporum var. nicotianae · F. oxysporum var. redolens · F. oxysporum var. trifolii · F. oxysporum vasinfectum · F. oxysporum zingiberi · F. pallens · F. pallidoroseum · F. pallidulum · F. pallidum · F. pampini · F. pandani · F. pannosum · F. parasiticum · F. paspali · F. paspalicola · F. peckii · F. pelargonii · F. peltigerae · F. penicillatum · F. pentaclethrae · F. personatum · F. pestis · F. pezizaeforme · F. pezizoides · F. phacidioideum · F. phaseoli · F. phormii · F. phyllogenum · F. phyllophilum · F. pisi · F. platani · F. platanoidis · F. poae · F. poincianae · F. polymorphum · F. polyphialidicum · F. proliferatum · F. proliferatum var. minus · F. proliferatum var. proliferatum · F. protractum · F. prunorum · F. pseudoanthophilum · F. pseudocircinatum · F. pseudograminearum · F. pseudoheterosporum · F. pseudonectria · F. pseudonygamai · F. pteridis · F. pulvinatum · F. punctiforme · F. putaminum · F. putrefaciens · F. pyriforme · F. pyrochroum · F. quercicola · F. radicicola · F. radicis-lycopersici · F. ramigenum · F. redolens · F. redolens dianthi · F. redolens solani · F. reticulatum var. negundinis · F. reticulatum var. negundinis · F. reticulatum var. reticulatum · F. rhabdophorum · F. rhizogenum · F. rhizophilum · F. ricini · F. rimicola · F. rimosum · F. robiniae · F. robustum · F. rollandianum · F. rosae · F. roseolum · F. roseum · F. roseum f. cereale · F. roseum var. avenaceum · F. roseum var. lupini-albi · F. rostratum · F. roumegueri · F. ruberrimum · F. rubi · F. rubicolor · F. rubiginosum · F. rubrum · F. sacchari · F. sacchari var. elongatum · F. sacchari var. sacchari · F. salicicola · F. salicicolum · F. salicinum · F. salicis · F. salmonicolor · F. samararum · F. sambucinum · F. sambucinum var. coeruleum · F. sambucinum var. ossicolum · F. sambucinum var. sambucinum · F. samoense · F. sanguineum · F. sapindophilum · F. sarcochroum · F. sarcochroum var. robiniae · F. schawrowi · F. schiedermayeri · F. schnablianum · F. schribauxii · F. schweinitzii · F. scirpi · F. scirpi var. caudatum · F. scirpisensu · F. sclerodermatis · F. sclerodermatis var. lycoperdonis · F. sclerotioides · F. sclerotioides brevius · F. sclerotium · F. scolecoides · F. secalis · F. semitectum · F. semitectum var. majus · F. setosum · F. socium · F. solani · F. solani cucurbitae · F. solani cyanum · F. solani f. cucurbitae · F. solani f. eumartii · F. solani f. mori · F. solani f. phaseoli · F. solani f. piperis · F. solani f. pisi · F. solani f. radicicola · F. solani f. robiniae · F. solani f. solani · F. solani f. xanthoxyli · F. solani fabae · F. solani minus · F. solani phaseoli · F. solani piperis · F. solani pisi · F. solani solani · F. solani var. javanicum · F. solani var. minus · F. solani var. petroliphilum · F. solaris · F. sophorae · F. sorghi · F. spartinae · F. speiranthis · F. spermogoniopsis · F. sphaeriae · F. sphaeroideum · F. sphaerosporum · F. spicaria-colorantis · F. splendens · F. sporotrichioides · F. sporotrichioides var. minor · F. sporotrichioides var. minus · F. sporotrichioides var. sporotrichioides · F. staphyleae · F. stercorarium · F. stercoris · F. sterilihyphosum · F. sticticum · F. stictoides · F. stilboides var. stilboides · F. stillatum · F. stoveri · F. striatum · F. strobilinum · F. stromaticola · F. stromaticum · F. subcarneum · F. subglutinans · F. subglutinans var. subglutinans · F. sublunatum · F. sublunatum var. elongatum · F. sublunatum var. sublunatum · F. subnivale · F. subpallidum · F. subpallidum roseum · F. subtectum · F. subulatum · F. subulatum brevius · F. subviolaceum · F. succisae · F. sulphureum · F. tabacivorum · F. tasmanicum · F. tenellum · F. tenue · F. tenuissimum · F. tenuistipes · F. thapsinum · F. theobromae · F. thuemenii · F. tomentosum · F. tortuosum · F. torulosum · F. tracheiphilum · F. translucens · F. tremelloides · F. trichothecioides · F. tricinctum · F. tritici · F. tubercularioides · F. tuberis · F. tuberivorum · F. tucumaniae · F. tumidum · F. udum · F. udum solani · F. udum var. crotalariae · F. uncinatum · F. uredinicola · F. urticearum · F. ustilaginis · F. vasinfectum · F. vasinfectum pisi · F. vasinfectum var. pisi · F. vasinfectum var. zonatum · F. venenatum · F. ventricosum · F. versicolor · F. versiforme · F. vinosum · F. violaceum · F. violae · F. virguliforme · F. viride · F. viticola · F. vogelii · F. volutella · F. wilkomii · F. willkommii · F. xylaroides · F. zavianum · F. zeae · F. zealandicum · F. ziziphinum · F. zizyphinum · F. zonatum. (ZIPCODEZOO, 2011)
O fungo Fusarium decemcellulare corresponde a um indivíduo com certas particularidades em relação aos outros indivíduos da espécie Fusarium, possuem uma grande macroconídia e características morfológicas que facilitam sua identificação. ( LESLIE, J.F, 2006)
Fusarium decemellulare é normalmente encontrado em áreas tropicais e subtropicais, onde ele é associado com superbrotamento e posterior morte de uma série de árvores frutíferas como abacate, cacau, guaraná e manga. (LESLIE, J.F, 2006)
O superbrotamento do guaranazeiro causado por Fusarium decemcellulare, é um dos principais problemas do guaranazeiro que possui uma grande importância econômica no Estado do Amazonas. (GASPAROTO, 2006)
De acordo com Farr e Rossman (2011) foram realizadas 31 registros de ocorrência de Fusarium decemcellulare em 22 espécies de hospedeiros diferentes: Annona xatemoya, Araucaria heterophylla (araucária), Bumelia tenax, Carya illinoensis, Cedrelinga cateniformis, Centrosema pubescens, Cordia alliodora, Cordia goeldiana, Crataegus flora, Ficus carica (figo) , F. tinctoria, Gliricidia sepium, Mangifera indica (manga) , Manilkara bidentata, Oryza sativa (arroz) , Paullinia cupana, Pinus resinosa, P. strobus, Psidium guajava (goiaba) , Tectona grandis, Theobroma cacao (cacau) e Ziziphus mauritiana. Estas descrições foram realizadas nos seguintes países: Austrália, Brasil, Canada, Costa do Marfim, Equador, El Salvador, Estados Unidos, Guatemala, Índia, Japão, Malásia, Nicarágua, Polônia, Porto Rico e Tanzânia. No Brasil, Fusarium decemcellulare foi descrita nas seguintes hospedeiras: Cordia alliodora, C. goeldiana, Mangifera indica, Paullinia cupana, Psidium guajava e Theobroma cacao.
Diversas variedades de fungos Fusarium, que são fungos comuns do solo, hábitos saprófitas, produzem várias micotoxinas diferentes do grupo dos tricotecenos, como o desoxinivalenol (DON), o nivalenol (NIV), a toxina T-2 e a toxina HT-2, bem como outras toxinas (zearalenona e fumonisinas), entretanto não foram encontradas informações referentes a produção de toxinas especificamente por parte de Fusarium decemcellulare. (QUALFOOD, 2011)
Nas literaturas consultadas não foram encontrados relatos sobre Fusarium decemcellulare agindo como patógeno humano ou de animais, nem deste sendo comestível ou utilizado na indústria farmacêutica, entretanto inúmeros são os relatos deste atuando como patógeno em plantas.
A cancrose é uma doença caracterizada pela formação de cancros nos orgãos lenhosos da planta de qualquer idade. As plantas jovens podem morrer e, nas adultas, acarreta rachaduras longitudinais e deformações nos galhos que, com o tempo podem matar a planta ou torná-la inutil. É causada pela forma anamórfica de Fusarium decemcellulare, Albonectria rigidiuscula, entretanto a infecção inicial é feita pelos conídios ou esporos do próprio Fusarium decemcellulare. É uma doença de grande expressão para a cultura da pinha no cerrado de Goiás, Minas Gerais e Distrito Federal. (JUNQUEIRA, et al., 2001)
A cancrose é uma doença caracterizada pela formação de cancros nos orgãos lenhosos da planta de qualquer idade. As plantas jovens podem morrer e, nas adultas, acarreta rachaduras longitudinais e deformações nos galhos que, com o tempo podem matar a planta ou torná-la inutil. É causada pela forma anamórfica de Fusarium decemcellulare, Albonectria rigidiuscula, entretanto a infecção inicial é feita pelos conídios ou esporos do próprio Fusarium decemcellulare. É uma doença de grande expressão para a cultura da pinha no cerrado de Goiás, Minas Gerais e Distrito Federal. (JUNQUEIRA, et al., 2001)
A erva-mate (Ilex paraguariensis) é uma espécie florestal cultivada no sul do Brasil e, em alguns municípios, é a principal atividade econômica. Sua ocorrência natural é restrita ao Brasil, Paraguai e Argentina, abrangendo cerca de 540.000Km². No Brasil, sua área está dispersa, sobretudo nos estados do Paraná, Santa Catarina e Rio Grande do Sul.Em 2004 foram constatados sintomas da doença podridão-de-raízes em ervais nos municípios da região alta do Vale do Taquari, RS. Com o auxílio de técnicos da EMATER, fez-se um levantamento dos municípios que possuíam ervais com sintomas. Em 10% dos ervais afetados, coletaram-se amostras de raízes que foram enviadas para análise no Laboratório de Fitopatologia pertencente ao Departamento de Defesa Sanitária/CCR/UFSM. Foram isoladas e identificadas cinco diferentes espécies do fungo Fusarium, dentre elas, Fusarium decemcellulare. (POLETTO,et al.2004)
O limão-de-Caiena (Averrhoa bilimbi L.) também conhecido por bilimbizeiro, da família Averrhoaceae, produz frutos que geralmente são processados salgados ou doces para confecção de conservas em picles, condimentos e molhos. Quando maduros esses são utilizados em geléias e compotas, constituindo boa fonte de vitamina C (Donadio et al., Frutas Exóticas, 1998 apud Bastos & Santos, 2001). Recentemente foi observado no município de Icoaraci, Pará, pés de limão-de-Caiena apresentando anormalidade nas inflorescências. Os sintomas se manifestam tanto no tronco, como nos ramos e caracterizam-se pelo desenvolvimento anormal de superbrotamento das inflorescências a partir do eixo floral, com inchamento dos talos florais. As flores e frutos jovens, geralmente caem prematuramente e os talos ficam totalmente secos. Material infetado foi coletado e levado para o laboratório de Fitopatologia da Ceplac, em Belém, Pará, para isolamento do agente causal. Os isolamentos procedidos em BDA, a partir de fragmentos de tecidos retirados de ramos infetados, revelaram a constante presença de um fungo, cujas características morfológicas identificou com agente causal Fusarium decemcellulare. (BASTOS & SANTOS, 2001)
Cateniformis cedrelinga é uma árvore leguminosa indígena que ocorre naturalmente nas regiões amazônicas do Equador, Peru e Colômbia. Esta árvore é economicamente valiosa para a produção de madeira e também é culturalmente importante para comunidades rurais e indígenas desses países que utilizam a ultilizam medicinalmente e também religiosamente. Em 2002 e 2003 observou-se sintomas de cancrose nestas árvores no Equador, através do isolamento de tecidos sintomáticos, descobriu-se a presença de Fusarium decemcellulare, sendo este também o agente causal. (LOMBARD, et al.2008)
O limão-de-Caiena (Averrhoa bilimbi L.) também conhecido por bilimbizeiro, da família Averrhoaceae, produz frutos que geralmente são processados salgados ou doces para confecção de conservas em picles, condimentos e molhos. Quando maduros esses são utilizados em geléias e compotas, constituindo boa fonte de vitamina C (Donadio et al., Frutas Exóticas, 1998 apud Bastos & Santos, 2001). Recentemente foi observado no município de Icoaraci, Pará, pés de limão-de-Caiena apresentando anormalidade nas inflorescências. Os sintomas se manifestam tanto no tronco, como nos ramos e caracterizam-se pelo desenvolvimento anormal de superbrotamento das inflorescências a partir do eixo floral, com inchamento dos talos florais. As flores e frutos jovens, geralmente caem prematuramente e os talos ficam totalmente secos. Material infetado foi coletado e levado para o laboratório de Fitopatologia da Ceplac, em Belém, Pará, para isolamento do agente causal. Os isolamentos procedidos em BDA, a partir de fragmentos de tecidos retirados de ramos infetados, revelaram a constante presença de um fungo, cujas características morfológicas identificou com agente causal Fusarium decemcellulare. (BASTOS & SANTOS, 2001)
Cateniformis cedrelinga é uma árvore leguminosa indígena que ocorre naturalmente nas regiões amazônicas do Equador, Peru e Colômbia. Esta árvore é economicamente valiosa para a produção de madeira e também é culturalmente importante para comunidades rurais e indígenas desses países que utilizam a ultilizam medicinalmente e também religiosamente. Em 2002 e 2003 observou-se sintomas de cancrose nestas árvores no Equador, através do isolamento de tecidos sintomáticos, descobriu-se a presença de Fusarium decemcellulare, sendo este também o agente causal. (LOMBARD, et al.2008)
Nos Estados Unidos, em Miami, observou-se por 20 anos, galhas grandes em árvores de manga, no pomar da USDA (United States Department of Agriculture) em Miami, Florida. Eles variam de 45 cm de diâmetro, têm áspera, exteriores escamosa, e normalmente são encontrados no tronco principal, analisando os tecidos internos das galhas observou-se a presença do fungo Fusarium decemcellulare, foi este o primeiro caso divulgado do indivíduo infectando uma mangueira nos EUA. (PLOETZ, R. 1996)
No Amazonas um dos principais problemas do guaranazeiro vem sendo o superbrotamendo das árvores de guaraná. A doença afeta ramos novos e inflorescências. Nos ramos ocorre emissão de brotações sucessivas formando uma massa densa e desuniforme, em conseqüência da multiplicação exagerada de células. Nas inflorescências ocorre multiplicação exagerada de células, dando às flores um aspecto de cálice compacto e endurecido, impedindo a polinização e causando o secamento precoce. (SBFITO , 2011)
O objetivo deste trabalho é apresentar aspectos gerais e morfológicos do fungo Fusarium decemcellulare.
No Amazonas um dos principais problemas do guaranazeiro vem sendo o superbrotamendo das árvores de guaraná. A doença afeta ramos novos e inflorescências. Nos ramos ocorre emissão de brotações sucessivas formando uma massa densa e desuniforme, em conseqüência da multiplicação exagerada de células. Nas inflorescências ocorre multiplicação exagerada de células, dando às flores um aspecto de cálice compacto e endurecido, impedindo a polinização e causando o secamento precoce. (SBFITO , 2011)
O objetivo deste trabalho é apresentar aspectos gerais e morfológicos do fungo Fusarium decemcellulare.
MATERIAIS E MÉTODOS
O trabalho foi conduzido inicialmente no Laboratório de Micologia da Embrapa Cenargem e também no Laboratório de Microbiologia do Instituto Federal Goiano Campus Urutaí.
Os propágulos fungicos foram extraídos de sementes de cacau que foram enviadas ao Laboratório de Micologia da Embrapa Cenargem, a área lesionada das sementes foram analisadas com um microscópio estereoscópico, após verificada a área da lesão, tomou-se uma agulha previamente flambada no bico de bunsen, e iniciou-se a extração dos propágulos por meio de raspagem da região.
Os propágulos fungicos foram extraídos de sementes de cacau que foram enviadas ao Laboratório de Micologia da Embrapa Cenargem, a área lesionada das sementes foram analisadas com um microscópio estereoscópico, após verificada a área da lesão, tomou-se uma agulha previamente flambada no bico de bunsen, e iniciou-se a extração dos propágulos por meio de raspagem da região.
Com uma pinça, uma lâmina foi cuidadosamente flambada no bico de bunsen, e no seu centro colocou-se uma gota de corante azul de algodão, na região da gota foram colocados cuidadosamente os propágulos, em seguida uma lamínula foi sobreposta à região, e o excesso de corante removido com o auxílio de papel toalha, e por fim a lamínula foi devidamente vedada com o uso de esmalte.
Levou-se então a lâmina para o microscópio óptico, inicialmente utilizou-se objetivas menores, como a de 4x a fim de localizar as estruturas fungicas presentes na lâmina, na medida em que eram localizadas, utilizava-se objetivas maiores para uma visualização mais detalhada das estruturas, de 10X e 40X. Após analisadas as estruturas e comparações com literaturas, identificou-se o fungo como pertencente ao gênero Fusarium sp., sendo este da espécie decemcellulare.
A lâmina semi-permanente foi trazida ao Instituto Federal Goiano Campus Urutaí por intermédio do professor Dr. Milton Lima, foram levadas ao microscópio óptico, com o objetivo de se micro fotografar as estruturas fungicas. Após localizadas com as menores objetivas, a imagem era aproximada com as objetivas maiores, e então fotografadas com uma câmera digital Canon modelo Shot A580 para a confecção da prancha de fotos a fim de tornar mais visível a descrição.
Com o auxílio do software paint, as fotos tiveram seu tamanho reduzido, em seguida organizadas em formato de prancha no software Power point.
Utilizando uma objetiva com unidades de medição, mediu-se também algumas as estruturas fungicas, a fim de estabelecer uma média de tamanho das estruturas.
RESULTADOS E DISCUSSÃO
Descrição Micológica
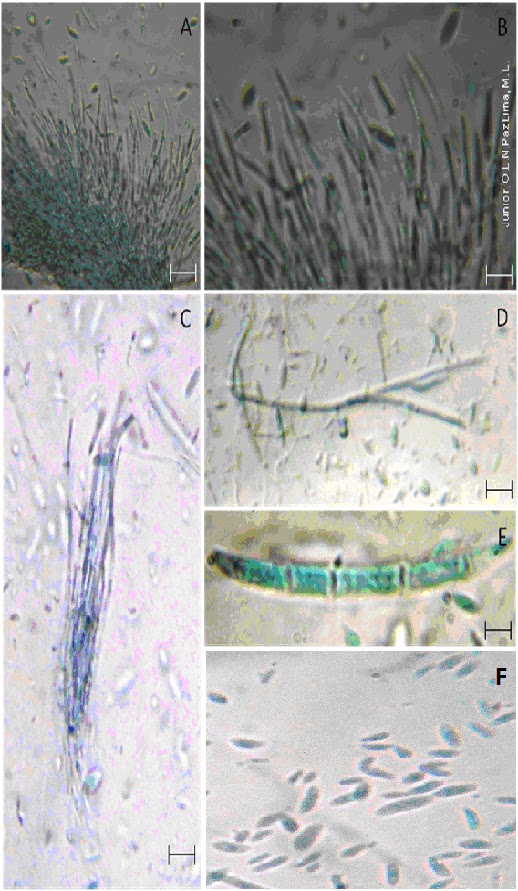
Figura 1. Aspectos morfológicos de Fusarium decemcellulare. Fig.A. Esporodóquio hialino (Bar=7,7 μm) Fig.B. Conídio, Célula conidiogênica (bar=20 μm) Fig.C.Esporodóquio (bar=20 μm) Fig.D.Conidióforos com conídios (bar=14 μm) Fig.E. Macroconidio septado, hialino e falcado (bar=62 μm) Fig.F. Microconídio hialino (bar=25,4 μm)
Descrição Micológica
Os macroconídios (Fig. E) raramente são confundidos com os de qualquer outra espécie por serem muito grandes tanto longos quando largos, em linha reta ou ligeiramente curvada e robusta com paredes espessas. Eles apresentam entre 5 e 9 septações, com uma célula apical e uma célula em forma de pé achatado. Macroconídios são produzidos em monophialides, em conidióforos ramificados, em esporodóquios e nas hifas.
Microconídios são encontrados em longas cadeias, produzidos a partir de monophialides, em conidióforos (Fig. D) ramificados ou diretamente a partir das hifas, tem forma oval e normalmente não são septados. Ausência de chlamidosporos. Esporodóquios hialinos (Fig. A), normalmente têm morfologia geral de aredes muito longas, robustas e espessas. Geralmmente abundante em esporodóquios, os macroconídios (Fig. E) de esporodóquios geralmente são uniformes em tamanho e forma.
Microconídios (Fig. F) adormecidos tipicamente em esporodoquios (Fig. C) onde eles dão origem a caracteristica em forma de massa.
Quadro comparativo:
Estruturas | Dimensões NUNES, O.L.2011 (μm) | Dimensões VEREINIGT, A.1908 (μm) |
Conídios | 12-18,5x4-9,5 | 13-17,5x5-10,5 |
Microconidio | 45-71,5x5,75 | 50-65 x 5-7 |
Esporodóquio | 85-125x12-16 | 80-120x10-15 |
Macroconidios | 37-49x6-8,5 | 39-48,5x5,75 |
As médias de Nunes, 2011 foram obtidas a partir da medição de 50 exemplares de cada estrutura, observasse uma leve variação em comparação as estruturas apresentadsa pelo autor Vereingt,1908
LITERATURA CITADA.
BASTOS¹ ,C. N. BASTOS1 & SANTOS, A. (2001). Superbrotamento de inflorescências do limão-de-caiena causado por Fusarium decemcellulare. Fitopatol. bras. 26(2), junho 2001
CEPLAC, Identificação e Manejo das Principais Doenças do Cacaueiro no Brasil, disponível em < http://www.ceplac.gov.br/Agrotropica/avulsos/livrofito.pdf>. Acessado em novembro de 2011.
FARR E ROSSMAN, Consulta ao banco de dados para hospedeiras de táxons fúngicos, disponível em < http://nt.ars-grin.gov/fungaldatabases/new_allView.cfm?whichone=FungusHost&thisName=Fusarium%20decemcellulare&organismtype=Fungus&fromAllCount=yes>. Acessado em dezembro de 2011.
GASPAROTTO, L.; PEREIRA, J.C.R. ; ARAÚJO; J.C.A ;DOENÇAS DE EXPRESSÃO ECONÔMICA DE CULTURAS EXPLORADAS NA AMAZÔNIA OCIDENTAL. Revista oficial da Sociedade Brasileira de Fitopatologia. VOL. 31 SUPLEMENTO, agosto, 2006.
INDEXFUNGORUM, Consulta ao banco de dados de táxons fúngicos. Disponível em < http://www.indexfungorum.org/Names/namesrecord.asp?RecordID=198322>. Acessado em novembro de 2011.
JUNQUEIRA, N.T.V¹; SANTIAGO, D.V.R²; PINTO, A.C.Q³; CHAVES, R.C. (2001). Principais doenças da fruteira-do-conde no cerrado. Circular técnico – Embrapa Cerrados Planaltina n.16, junho 2001.
LESLIE, J.F, Summerell, B.A. The Fusarium laboratory manual – Blackwell Publishing, Oxford UK
LOMBRAD, L.¹*; BOGALE, M.²; MONTENEGRO Ecuador
PLOETZ, R. First Report of Fusarium decemcellulare as a Pathogen of Mango in the United States.(1996) The American Phytopathological Society. DOI: 10.1094/PD-80-1207C.
POLETTO¹, I.; MUNIZ²,M. F. B.; CECONI³, D.E³.; SANTIN, D.
DECONTO, M.N. BLUME, E.W.(2006) Zoneamento e identificação de Fusarium spp. causadores de podridão de raízes em plantios de erva-mate(Ilex paraguariensis A. St.-Hil.) na região do vale do Taquarí, RS.
QUALFOOD, Novo Regulamento: Toxinas Fusarium < http://qualfood.biostrument.com/?option=noticia&task=show&id=755>. Acessado em outubro de 2011.
REDALYC, Ciência Florestal, disponível em < http://redalyc.uaemex.mx/pdf/534/53416101.pdf>. Acessado em outubro de 2011.
SBFITO, Suplemento, disponível em < http://www.sbfito.com.br/tpp/Suplemento_2006_Salvador.pdf>. Acessado em outubro de 2011.REDALYC, Ciência Florestal, disponível em < http://redalyc.uaemex.mx/pdf/534/53416101.pdf>. Acessado em outubro de 2011.
SBFITO, Suplemento, disponível em < http://www.sbfito.com.br/tpp/Suplemento_2006_Salvador.pdf>. Acessado em outubro de 2011.